コンテンツ
アミノ酸からタンパク質
アミノ酸の基本構造
タンパク質は20種類のアミノ酸によって構成されている。アミノ酸の基本構造を以下に示す。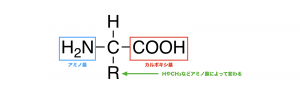
アミノ酸の中心に位置する炭素(α-炭素)はR=H(グリシン)以外は不斉炭素となっており、光学異性体が存在する。
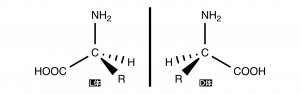
L体とD体が存在する。これらの配置は覚えておくべきであろう。ちなみに天然に存在するうちの9割がL体である。
アミノ酸の種類
ここでは先ほど述べた20種類のアミノ酸の構造について書きたいと思う。ノーヒントで書かされることもあったので丸覚えしておこう。
~画像省略~
ちなみにこれらのアミノ酸は画像のような形で溶液中(タンパク質中)に存在するわけではない。ーCOOH基はーCOO-、ーNH2期はーNH3+の形をとっている(等電点下)。
等電点について記述しておく。等電点とはアミノ酸中の実行電荷が0となる点である。実行電荷とは以下の図を参照してほしい。
~画像省略~
等電点の値によってそのアミノ酸の加電圧下での振る舞いや、滴定曲線の形が変化する。
例えば、グルタミン酸(等電点=3.2)のアミノ酸はpH7.0の緩衝溶液中ではどのように振舞うだろうか。
- 電場をかけると陽極に向かって泳動する。
- 電場をかけると負極に向かって泳動する。
- 電場をかけても泳動しない。
グルタミン酸の等電点がpHより小さい。このためグルタミン酸は負電荷をもつので陽極側へ移動する。よって答えは1である。
もう少し詳しく解説すると、グルタミン酸のR基=ーCH2CH2ーCOOHである。pH7.0の電場中ではルシャトリエの原理によりR基のーCOOHがプロトンを放出し、
R=ーCOO- & H+
といったようにアミノ酸残基自体は負電荷を持つようになるため陽極側へアミノ酸が移動する。
以下に特徴的な等電点をもつアミノ酸を記述しておく。覚えておこう。
| アミノ酸 | 等電点 |
| 酸性アミノ酸 | |
| アスパラギン酸 | 2.77 |
| グルタミン酸 | 3.22 |
| 塩基性アミノ酸 | |
| リシン | 9.74 |
| その他 | |
| ヒスチジン | 7.0 |
以上を覚えておけば等電点での振る舞いは完璧に回答できるであろう。
では逆に以下の情報から等電点を求めてみよう。
・グルタミン酸の25℃下での酸性及び塩基性基のpKaは以下の通り。(αカルボキシ基=2.1、αアミノ基=9.1、側鎖=4.1)等電点を求めよ。
まず考えるべきは等電点下でのグルタミン酸の組成である。安易に(4.1+9.1)/2=6.6などと回答してはいけない。
等電点とは先ほど述べたように実行電荷が0になっているためーCOO-、ーNH3+、ーCOOH(残基)となっているはずである。
~画像省略~
したがって答えは(2.1+4.1)/2=3.1となる。
複数のアミノ酸
これまで一つのアミノ酸について書いてきた。この項ではアミノ酸が結合したときの振る舞いについて書いていこうと思う。
アミノ酸同士が互いのαカルボキシ基とαアミノ基とが脱水して形成した結合をペプチド結合といい、二つ以上のアミノ酸がペプチド結合したものをポリペプチドという。
~画像省略~
ペプチド結合内の原子団をペプチド原子団というわけだが、このペプチド原子団内では電子が非局在化しており、部分的な二重結合を形成するためC-N結合が自由回転せず、平面的な構造を持つ。
その限定的な範囲のなかでどこまで動かせるかをプロットしたもの,つまり「ポリペプチド鎖の中で可能なCα-C,Cα-Nの回転角の範囲を示したプロット」をラマチャンドラプロットという.さきほどペプチド原子団は平面性を有するといった通り,原子団全体がゆがむことで立体障害を回避している.
ポリペプチドはその結合様式から様々な構造を形成する。以下にまとめてみた。
| 階層性 | 構成要素 | 結合 | |
| 一次構造 | アミノ酸 | ペプチド結合(共有結合) | |
| 二次構造 | α-ヘリックス、β-シートetc | 水素結合 | |
| 三次構造 |
|
| |
| 四次構造 | サブユニット |
|
それぞれの構造について解説してゆく
二次構造
二次構造とはポリペプチド主鎖のアミド窒素とカルボニル酸素との間の水素結合により構成される部分構造である.αーヘリックスやβシートがその例である.それぞれについて解説してゆく.
α-ヘリックス
αーヘリックスはらせん状の構造をもつポリペプチドである.n番目の残基のカルボニル酸素がn+4番目のN-Hと水素結合している.一つの閉じた水素結合系は13原子から構成されている.
~画像省略~
βシート
らせん状の構造をもつのがαーヘリックスと先ほど述べたが,対してほぼ完全に延びたポリペプチド鎖(βーストランド)が隣接しあい,一方の主鎖のカルボニル基が隣接するストランド主鎖のN-H基と水素結合することにより形成される構造がβシートである.
~画像省略
隣接するβストランドが互いに同じ向きのものを特に平行βシート,逆向きのものを逆平行βシートとよぶ.
シート状構造は側鎖が平面の上下に突き出した形となっており,ひだ状になっている.加えてほとんどの場合ねじれている.
平行βシートと逆平行βシートの違いを以下の表にまとめた.
| 名称 | 隣接するβストランド | 水素結合の様子 |
| 平行βシート | 同方向 | ストランドの方向に対して非垂直であり,等間隔になっている. |
| 逆平行βシート | 逆方向 | ストランドの方向に対して垂直で.広い狭いが交互になっている. |
総括
以上の二次構造はターン(5残基程度)もしくはループ(それ以上)によりつながれており,方向転換している.これらは例外なく水素結合により安定化されている.
三次構造
さきほどまでに述べた2次構造が折りたたまれたものである(超二次構造).
※厳密には少し違って三次構造と三次元構造で区別されているが上記の理解でも間違いではない
二次構造は水素結合により形成される構造であったが,この三次構造は側鎖間に働く相互作用の結果としておこる.ポリペプチド鎖が折りたたまれ,コンパクトな球状分子となる過程を通してタンパク質分子内部から水分子が排除されて鎖間での相互作用が働くようになる.
したがって間違っても三次構造の構成要素が水素結合などと回答してはならない.繰り返しいなるが,三次構造とは水素結合により構成された二次構造が以下の相互作用によって形成された構成単位である.
三次構造は下記の相互作用により安定化されている.
- 疎水性相互作用
- 静電的相互作用(塩橋,双極子,水素結合,ファンデルワールス力)
- 共有結合(ジスルフィド結合)
三次構造を細分化した時に独特に折りたたまれた構造をドメインと呼ぶ.
四次構造
複数のポリペプチド鎖の会合状態であるサブユニットにより構成される構造.配置と構成によってそれぞれ名称が存在する.モノマー(単量体),ホモダイマー(ホモ二量体),ヘテロダイマー(ヘテロ二量体),三量体,四量体…といった風である.
タンパク質の応用
これまでタンパク質の構成要素を述べてきた.この項ではタンパク質の変性,有機溶媒などについて述べる.
タンパク質の変性
タンパク質の機能はそのコンホメーション(立体配座)に依存する.←単結合の周りの自由回転により生じる原子団の空間配列
コンホメーションが破壊されることを変性という.変性によりタンパク質はその機能を失う.変性は一般的には不可逆の反応である.
その要因としては熱,極端なpH,変性剤,物理的ストレスなどがある.それぞれについて以下で解説する.
熱変性
卵白が加熱すると白くなるアレである.仕組みとしては温度の上昇に伴って水分子の自由度が上昇,タンパク質内の静電的相互作用が切断されることで変性が起きる.
酸変性,アルカリ変性,等電点沈殿
pHの変化は側鎖のプロトン化状態を変化させ,静電的相互作用の様式が変化,タンパク質のコンホメーションが変化する.極端なpHによりタンパク質のコンホメーションを大きく変化する.
等電点ではタンパク質は電荷を失い不溶性となって沈殿する.
高次構造とタンパク質機能との関連
この項ではミオグロビンとヘモグロビンを例に挙げ,実際のタンパク質の振る舞いを見ていくが,どうせ出題されないだろうと高を括っていたらガッツリ出題されボコボコにされたのでちゃんと覚えておこう.
ミオグロビンとヘモグロビンについて以下にまとめる.
| 名前 | 所在 | 役割 | 四次構造 | 酸素結合曲線 |
| ミオグロビン | 筋肉 | 酸素の貯蔵 | 単量体 | 双曲線型 |
| ヘモグロビン | 赤血球 | 酸素の運搬 | ヘテロ四量体 | シグモイド型 |
ミオグロビン
ミオグロビンは骨格筋や心筋に存在する酸素結合タンパク質であり,補欠分子族としてヘム(鉄錯体)を含む.このヘムの鉄原子に酸素が結合し,酸素を貯蔵している.
ミオグロビンは8本のαーヘリックスからできている.
ヘモグロビン
ミオグロビンと配列類似性の高い二種類のたんぱく質からなるヘテロ四量体としてふるまう.1分子のヘモグロビンは4つの酸素分子を結合する.
ミオグロビンとヘモグロビンの酸素結合特性比較
~画像省略~
酸素の運搬という役割を考慮するとヘモグロビンの酸素結合曲線はたいへん理にかなっている.
- 酸素分圧の高い肺で酸素高親和性となり,酸素を十分に結合
- 酸素分圧の低い組織で酸素低親和性の構造に転換→酸素を手放す(組織のミオグロビンに酸素を供与)
この切り替えは酸素結合に伴うヘモグロビンのコンホメーション変化によるものである.
酸素が一つのサブユニットに結合するとそのサブユニットの立体配座が酸素高親和性型に変化し,さらにその立体配座が他のサブユニットにも波及し,すべてのサブユニットが酸素高親和性型になる.
最初の一個目の酸素分子が結合するとT→Rへの構造変化が起こり,残りの3個の酸素分子がヘモグロビンに結合しやすくなる.
酸素に対する親和性は酸素結合が増加する.これを正の協同性という.
ヘモグロビンの正の協同性
構造転換はヘモグロビンがオリゴマー構造をとり,ひとつのサブユニットの構造変化が他のサブユニットに波及することによる.
ミオグロビンのような単量体タンパク質ではこのような協同性はみられない.一般にあるタンパク質が協同性を示すとき,タンパク質はサブユニット内に構造的連絡のあるオリゴマー酵素であるといえる.なお,すべてのオリゴマー酵素がすべて協同性を示すわけではない.
まとめ
基礎生物化学の資料をもとにして作成しました.